自主新药有望加快“落地”,三类国产新药或将受益
··
国产自主创新的老年痴呆药甘露寡糖二酸获批上市后引起了广泛的关注和议论,一些医生和专家质疑甘露寡糖二酸的疗效,有人怀疑研发者的能力,有人曝光生产商的过往。
热闹之中,大家忽视了一个重要事实,这个老年痴呆药是突击审批的。最近还有一些国产新药技术审评之后的程序在加速,临床急需药品附条件批准等3个加快审批文件周五开始征求意见,几者联系起来或透露出国产新药审批进程加快的信号。
老年痴呆药现场检查后10个工作日就获批
新药上市审批程序中,药审中心通过技术审评后,进入现场检查程序,并抽取样品送到中检院检验,样品检验的周期一般需要1个月,时间长的需要2个月;如现场检查和样品合格,药审中心将材料提交至国家药监局,进入行政审批程序,行政审批的时间一般要20个工作日。
国家药监局审验中心公开信息显示, 10月15日至10月19日,审验中心对甘露寡糖二酸和甘露寡糖二酸胶囊进行了现场检查,但11月2日国家药监局就宣布有条件批准这个创新药上市,从完成现场检查到获批只有10个工作日。显而易见,这是突击审批的。而国家药监局“药品注册进度查询”中公开的办理状态,甘露寡糖二酸还在药审中心“审评审批中”,看来信息更新的速度没有赶上审批的速度。
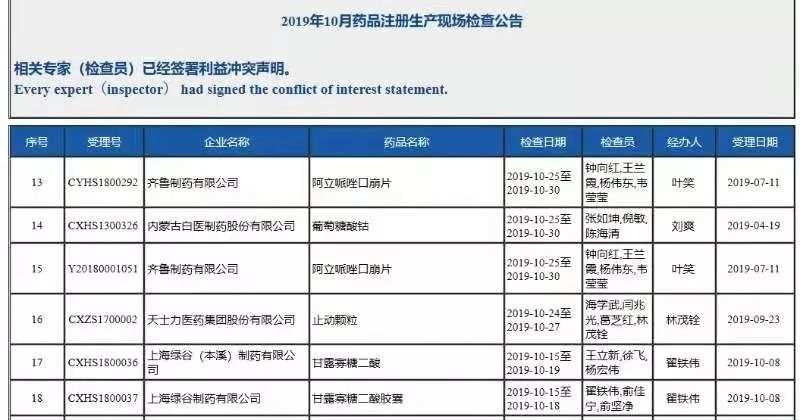
这样的审批速度,去年4月见到过。在高层视察上海时提出加快上市进程后,默沙东的九价宫颈癌疫苗跳过临床试验的审批程序,当月提出上市申请当月获批。不过,甘露寡糖二酸是国产创新药,九价宫颈癌疫苗是进口药。
2018年8月,百奥泰提交生物类似药——阿达木单抗上市申请,2018年11月被纳入优先审评,11月7日完成行政审批,速度也相当快。记者还从一些药企那里获悉,最近,他们申报的新药审批程序也加快了。
现行审批制度下进口药获批速度更快
近年,国家药监局进行了一系列新药审批制度改革。其中一项,是5个工作日内受理和事前沟通制度。实际操作中,为了加快受理后的进程,受理中心会对申报资料进行详细的初步审查,国产新药因为需要反复补充资料,从提交申请到正式受理大概需要2、3个月的时间,而进口原研药一般已在境外注册,资料齐全,受理时间相对要短。如康泰生物在半年报中就说,正在准备申请13价肺炎疫苗注册,但至今未见到其正式受理的消息。
据国家药监局药审中心《2018年度药品审评报告》,当年通过审评的新药,进口原研药67个,国产创新药9个。进口药的获批数量远高于国产创新药,原因是现行新药审批制度导致进口药获批速度更快。
2018年7月10日,国家药监局发布《接受药品境外临床试验数据的技术指导原则》,开始接受药品境外临床试验数据用于新药上市注册申请。2018年10月23日,国家药监局和国家卫健委联合发布《临床急需境外新药审评审批工作程序》,建立专门通道对临床急需的境外已上市新药进行审评审批。凡进入通道的品种,不管是否已在中国提交临床申请,均可直接提交或变更为上市申请, 药审中心受理后3个月内完成技术审评(对其他境外新药,在受理后6个月内完成技术审评),国家药监局在接到药审中心报送的审核材料后10个工作日作出审批决定。
前面提到,百奥泰的阿达木单抗上市申请,从2018年8月受理到2019年11月7日完成行政审批,速度已经很快了,也有15个月的时间,而进入专门通道的进口药,正常的话6个月即可走完整个审评审批流程。由此,从技术审评程序来看,进口新药要比国产新药的时间短,如果进入特别通道,进口新药完成技术审评的时间可能只有国产新药的几分之一。
11月8日,药审中心发布《优先审评审批工作程序(征求意见稿)》,对纳入优先审评审批程序的药品上市注册申请,审评时限为120日,其中临床急需的境外已上市的罕见病药品审评时限为60日。在这个最新的工作规范中,国产新药与进口罕见病药的审评速度上还是有差距。
我们再从现场检查程序来看。2017年,国家药监局加快仿制药一致性评价工作,先是对申报一致性评价仿制药进行临床核查,后又将审验力量主要放到一致性评价的现场检查中,导致新药的现场检查通道堵塞,常常出现6个月都排不上队的情况,影响了新药的审批速度。而进口新药大多不需要现场检查,这个影响主要是对国产新药的影响。
我们来看进口和国产PD-1单抗的审批情况。2018年2月,默沙东向药审中心“K药”递交临床数据报告及上市申请,2018年7月获批上市,用时5个月;2018年3月20日,君实生物提交特瑞普利单抗上市申请,2018年12月获批,用时9个月;2018年4月,信达生物和恒瑞医药也提交PD-1单抗上市申请,分别于2018年12月和2019年5月获批。最新的信息,“K药”第4个适应症已于11月6日进入行政审批程序,是目前获批适应症最多的PD-1。
所以,从新药审批制度和实际操作来看,进口新药的审批速度往往更快。
多家医药巨头全球增长平淡但中国市场高速增长
10月29日,辉瑞公布2019年前3季度业绩报告,前3季度全球销售收入390.62亿美元,同比增长1%,在中国区的运营增长42%,且生物制药业务收入大于普强业务。
在这之前,阿斯利康也公布了2019年第三季度财报和前三季度业绩,前9个月全球业绩为177.20亿美元,以恒定汇率计算同比增长17%;中国地区业绩36.91亿美元,以恒定汇率计算同比增长37%。
默沙东在中国市场的增速更高。2019年第三季度,默沙东全球销售额为124亿美元,同比增长15%,中国市场营收8.98亿美元,同比增长84%,排除外汇的不利影响,同比增长90%。默沙东在中国市场接近翻倍的增长,主要受益于去年获批的癌症新药“K药”和九价宫颈癌疫苗。
从这3家公司来看,中国市场成为其增长的来源,中国市场的绝对收入也占有较大的比重。
去年12月,国家医保局启动仿制药4+7集中采购招标,今年9月4+7集中采购扩围招标,两轮招标下来,很多中标储罐药的价格降幅达到90%左右。卫健委也将一些临床价值不同的中药注射液等列入限制使用目录。在压缩仿制药等价格的同时,医保局等加大了抗癌药等新药的医保报销范围和幅度,新药大为受益。因此,刚刚披露结束的制药企业3季报中,业绩冰火两重天,中标4+7集中采购的德展健康业绩大幅下降,生产创新药的贝达药业,即使只有一个品种,前三季度营业收入和归母净利润均实现34%的增长。
新药新政给创新药企带来了高速的增长和良好的利润回报,但因为国际医药巨头创新药多,更为受益。恒瑞医药是我国“医药一哥”,今年前三季度收入增长36%,三季度单季度实现收入增长47.3%,增速是可以与国际巨头抗衡,但前三季度169.45亿元的营业收入还是要小于阿斯利康从中国地区获得的36.91亿美元的收入。
显然,有关方面已意识到,如果不加快国产创新药的审批,或不将进口新药和国产新药以同等的速度审批,将不利于我国制药业的发展。
临床急需药品附条件批准等3个加快审批文件征求意见
11月8日,药审中心网站集中发布了临床急需药品附条件批准上市等5个文件。其中,《临床急需药品附条件批准上市技术指导原则》、《突破性治疗药物工作程序》和《优先审评审批工作程序》3个征求意见稿涉及新药加快审批。
药审中心称,药品上市注册申请时,以下情形可申请进入优先审评审批程序:1.纳入突破性治疗药物程序的药品;2.纳入附条件批准上市注册的药品;3.临床急需的短缺药品;4.防治重大传染病和罕见病等疾病且具有明显临床价值的创新药和改良型新药;5.具有明显临床价值且符合儿童生理特征的儿童用药品新品种、剂型和规格;6.疾病预防、控制急需的疫苗;7.具有明显临床价值的创新疫苗。对纳入优先审评审批程序的药品上市注册申请,审评时限为120日,其中临床急需的境外已上市的罕见病药品审评时限为60日。
附条件批准上市是指用于治疗严重危及生命且尚无有效治疗手段的疾病以及罕见病的药品、公共卫生方面急需的药品,现有临床研究资料尚未满足常规上市注册的全部要求,但药物临床试验已有数据显示疗效并能预测其临床价值,可附条件批准上市。在《临床急需药品附条件批准上市技术指导原则》中,药审中心放宽了临床急需药品的认定标准,下列情形也可列为临床急需药品范围:与现有疗法相比,对疾病的预后有明显改善作用;用于对现有疗法不耐受或无疗效的患者可取得明显疗效;可以与现有疗法不能联用的其他关键药物或治疗方式有效地联用并取得明显疗效;疗效与现有疗法相当,但可避免现有疗法的严重毒性,或降低有害的药物相互作用,或显著改善病人的依从性;解决新出现或预期会发生的公共卫生需求。
《突破性治疗药物工作程序》主要针对的是药物临床试验。用于防治严重危及生命的疾病或者严重影响生存质量,且尚无有效防治手段或者与现有治疗手段相比有充分证据表明具有明显临床优势的创新药或改良型新药,可申请突破性治疗药物程序。纳入名单的新药,药审中心进行临床试验研制指导,按照药物纳入突破性治疗药物程序的时间顺序优先配置资源进行沟通交流,加强指导并促进药物研发进程。申请人做好准备工作后可随时提出与药审中心进行沟通交流的申请。
《优先审评审批工作程序》、《临床急需药品附条件批准上市技术指导原则》实施后,真正的创新药将缩短临床试验时间、提前上市,这对创新药企业是非常有利的。特别是,《临床急需药品附条件批准上市技术指导原则》里未区分进口药、国产药,以及中药、西药,将国产药的加快审批放到了进口新药同等的位置。
当然,要缩短国产新药审批时间,仅加快技术审评是不够的。目前,缩短正式受理前的沟通时间、国产新药现场检查的等待时间也是急需解决的。
三类国产新药将明显受益?
假设国产新药将加快审批,受益的大概有三种类型:
第一类,已完成技术审评,正在等待现场检查、样品检验的品种。如沃森生物的13价肺炎疫苗,已完成现场检查,现在样品检验中,预计会缩短样品检验的周期。
第二类,已纳入优先审评名单的国产创新药。此前由于审评资源的调度问题和审评人员对国产创新药严苛的审查,时间拖得比较长,积压的数量也比较多,在有了120日的明确的时间限制后,积压的品种预计将先受益。
第三类,细胞治疗、免疫治疗的创新疗法,在《临床急需药品附条件批准上市技术指导原则》和《突破性治疗药物工作程序》配合之下,临床试验的周期会缩短,附条件上市将加快其上市进程。本周,ASH年会网站公布金斯瑞(南京传奇)LCAR-B38MCART疗法美国PhaseIb/II临床CARTITUDE-1数据摘要,并更新中国区临床数据。中信建投点评时说,美国临床数据惊艳,具备全球同类最佳潜力,预计公司还将在12月7-10日通过口头报告发布。如果届时公布的数据仍然较好,极有可能进入临床急需药品附条件批准上市名单而加快上市进程。



